Contato:Errol Zhou (Senhor.)
Telefone: mais 86-551-65523315
Celular/WhatsApp: mais 86 17705606359
QQ:196299583
Skype:lucytoday@hotmail.com
E-mail:sales@homesunshinepharma.com
Adicionar:1002, Huanmao Edifício, Nº 105, Mengcheng Estrada, Hefei Cidade, 230061, China
Recentemente, o rótulo aberto II da AstraZeneca teve como alvo o medicamento anticâncer Koselugo (selumetinib) para o tratamento de neurofibroma plexiforme sintomática e não ressecável (PN) em pacientes pediátricos com neurofibromatose tipo 1 (NF1) Os resultados do ensaio SPRINT Stratum 1 (NCT01362803) foram publicados online no New England Journal of Medicine (NEJM). O título do artigo é: Selumetinib in Children with Inoperble Plexiform Neurofibromas.
NF1 é uma doença genética do sistema nervoso que faz com que tumores cresçam nos nervos. Esses tumores (neurofibroma plexiforme) podem crescer em qualquer lugar do corpo, incluindo a face, membros, ao redor da coluna vertebral e áreas do corpo que podem afetar órgãos . Os sintomas mais comuns relacionados à neurofibromatose incluem desfiguração, disfunção motora e dor. Dados do estudo SPRINT Stratum 1 mostram que o tratamento koselugo tem benefícios clínicos significativos para os pacientes, que podem continuar a reduzir o volume do tumor, aliviar a dor, melhorar a função diária e a qualidade de vida em geral relacionada à saúde.
Koselugo é um novo inibidor de quinase oral que foi aprovado pela FDA dos EUA em meados de abril deste ano. É usado para pacientes pediátricos com neurofibromatose tipo 1 (NF1) com idade ou dois anos para tratar neurofibromatose de plex infeccionista e inoperável (PN) relacionada à NF1. Vale ressaltar que o Koselugo é o primeiro medicamento aprovado pela FDA dos EUA para tratar a NF1. Anteriormente, Koselugo foi premiado com a qualificação de drogas órfãs (ODD) e a qualificação de drogas inovadoras (DBT) para o tratamento de NF1. Koselugo é um inibidor da quinase, ou seja, age através de enzimas-chave, impedindo assim o crescimento de células tumorais.
Neurofibroma plexo (PN) (Fonte da imagem: cancerworld.info)
NF1 é uma doença rara que é debilitante, progressiva e muitas vezes causa desfiguração. Esta doença geralmente começa cedo na vida e é causada por mutações ou defeitos em genes específicos. NF1 é geralmente diagnosticado cedo na infância. A NF1 ocorre em cerca de um em cada 3.000 bebês e é caracterizada por alterações na cor da pele (pigmentação), danos nos nervos e ossos, e o risco de desenvolver tumores benignos e malignos ao longo da vida. 30% a 50% dos pacientes com NF1 têm um ou mais neurofibromas plexiformes (PN). O principal tratamento para PN é a ressecção cirúrgica. Infelizmente, devido à localização ou volume desses tumores, muitos pacientes não são adequados para cirurgia. Além disso, a PN geralmente se repete após a ressecção cirúrgica ideal e, portanto, representa uma área importante onde as necessidades médicas não são atendidas.
O estudo SPRINT Stratum 1 foi patrocinado pelo National Cancer Institute (NCI) Cancer Therapy Evaluation Program (CTEP). O estudo inscreveu 50 pacientes pediátricos (idade mediana de 10,2 anos, faixa: 3,5-17,4). Essas crianças tinham NF1 E PN inoperável (definida como PN que não pode ser completamente removida, mas não representa um sério risco para o paciente). Os sintomas mais comuns relacionados à neurofibromatose são desfiguração (44 casos), disfunção motora (33 casos) e dor (26 casos). No estudo, os pacientes tomaram Koselugo 25 mg / m2 (dose recomendada aprovada) duas vezes ao dia até que a condição se deteriorasse ou reações adversas inaceitáveis ocorressem. Durante o período experimental, as alterações no volume tumoral do paciente e os sintomas da doença relacionada ao tumor foram avaliados rotineiramente, e foi determinada a taxa de resposta global (ORR), que foi definida como: 3-6 meses por ressonância magnética confirmada remissão total ou parcial (redução do volume do tumor PN ≥ 20%).

Dados publicados no NEJM mostram que, em 29 de março de 2019, 35 dos 50 pacientes tiveram remissão confirmada, ou seja, a taxa total de remissão (ORR) de Koselugo duas vezes por dia a monoterapia oral foi de 70% (n = 35 /50), todos os pacientes têm remissão parcial (RP). Dos 35 pacientes com remissão confirmada, 28 (80%) apresentaram remissão sustentada (duração da remissão ≥ 1 ano). Além disso
O estudo também avaliou o impacto do Koselugo em outros desfechos clínicos, incluindo alterações nos defeitos relacionados à PN, sintomas e comprometimento funcional. Apesar do pequeno tamanho amostral dos pacientes que avaliam cada morbidade relacionada à PN (como defeitos, problemas de dor, força e mobilidade, compressão das vias aéreas, deficiência visual e disfunção bexiga ou intestinal), deficiências relacionadas à PN, sintomas e função durante o tratamento O dano também apresentou melhora.
Especificamente: Após 1 ano de tratamento, o escore de intensidade da dor tumoral relatado pelo paciente diminuiu em média 2 pontos, o que é considerado melhora clinicamente significativa. Além disso, as funções diárias (38% e 50%, respectivamente) e a qualidade de vida em geral relacionada à saúde (48% e 58%, respectivamente) e força (56%) e amplitude de movimento (38%) nos relatos das crianças e dos pais No desfecho, observou-se também melhora na significância clínica.
Em um acompanhamento de 3 anos, a taxa de sobrevivência livre de progressão da doença no grupo de tratamento koselugo foi de 84%, em comparação com 15% no grupo de controle da história natural. Durante o estudo, 5 pacientes interromperam o tratamento devido a possíveis efeitos tóxicos relacionados ao Koselugo, e 6 pacientes se deterioraram. As reações tóxicas mais comuns são náuseas, vômitos, diarreia, aumento assintomático nos níveis de creatina fosfoquinase, erupção cutânea semelhante à acne, paronychia.
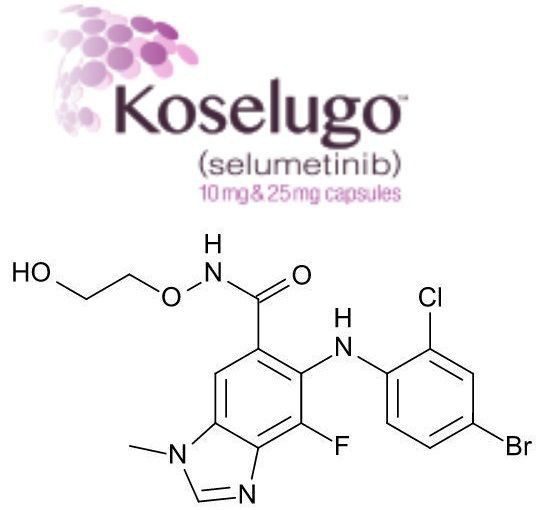
O ingrediente farmacêutico ativo de Koselugo é o selumetinibe, que é um inibidor oral, potente e seletivo MEK1 / 2 quinase. O gene NF1 codifica neurofibromin (neurofibromin), que regula negativamente a via RAS / MAPK e ajuda a controlar o crescimento celular, diferenciação e sobrevivência. Mutações no gene NF1 podem fazer com que o caminho de sinalização RAS / RAF / MEK / ERK se torne não regulado, o que pode fazer com que as células cresçam, se dividam e se reproduzam de forma descontrolada, podendo causar o crescimento do tumor. Selumetinib potencialmente inibe o crescimento tumoral inibindo a enzima MEK nesta via. Atualmente, o selumetinibe está sendo avaliado em estudos clínicos como uma monoterapia e em combinação com outras terapias para o tratamento de múltiplos tipos de tumores.
selumetinib foi descoberto pela Array BioPharma, e a AstraZeneca foi autorizada em 2003 a obter direitos globais exclusivos para o composto. Em julho de 2018, a AstraZeneca e a Merck chegaram a uma cooperação estratégica em oncologia para desenvolver e comercializar conjuntamente o inibidor de selumetinib e PARP Lynparza globalmente. Atualmente, ambas as partes estão conduzindo um estudo clínico de fase I/II, SPRINT, para explorar os benefícios potenciais do selumetinibe em pacientes pediátricos com neurofibromas plexiformes inoperáveis nf1 (PN).
Neurofibromatose tipo 1 (NF1) é uma doença genética incurável com uma incidência de cerca de 3.000 a 4.000 em bebês. A doença é causada por uma mutação espontânea ou mutação genética no gene NF1 e está associada a muitos sintomas, incluindo aglomerados macios (neurofibromas subcutâneos) na superfície da pele e na pele, a pigmentação da pele (placas de leite de café), em tumores de bainha nervosa benigna (neurofibromas plexiformes [PN]) também pode ser causada em 20% a 50% dos pacientes. Estes neurofibromas plexiformes (PN) podem causar dor, disfunção motora e desfiguração.
Pessoas com NF1 podem ter muitas outras complicações, como dificuldades de aprendizagem, torção e dobra da coluna vertebral, hipertensão e epilepsia. A NF1 também aumenta o risco de outras pessoas de outros cânceres, incluindo tumores malignos do cérebro e da bainha do nervo periférico e leucemia. Os sintomas da doença começam cedo na infância e variam muito em gravidade, o que pode reduzir a expectativa de vida em até 15 anos.
Fonte:Selumetinib em Crianças com Neurofibromas Plexiformes Inoperáveis